Zuurstofcorrosie
Bij zuurstofcorrosie worden opgeloste zuurstofmoleculen gereduceerd tot hydroxide (OH−) ionen, waarbij het metaal gelijktijdig reageert tot een oxide. Het roesten van ijzer is een voorbeeld van zuurstofcorrosie.
Dit kan weergegeven door de reactie weer te geven als enkele (denkbeeldige) halfreacties:
- 6 H2O + 3 O2 + 12 e− → 12 OH−
- 4 Fe → 4 Fe3+ + 12 e−
- 4 Fe3+ + 12 OH− → 2 Fe2O3 + 6 H2O
Deze halfreacties leveren samen:
- 4 Fe + 3 O2 → 2 Fe2O3
Zuurstofcorrosie treedt op in een vochtige omgeving die neutraal of basisch is. Voorts moet de metaal/metaaloxidereactie een lagere standaard redoxpotentiaal hebben dan het redoxpaar O2 / OH− (0,4 volt).
Onderstaand een afbeelding van zuurstofcorrosie
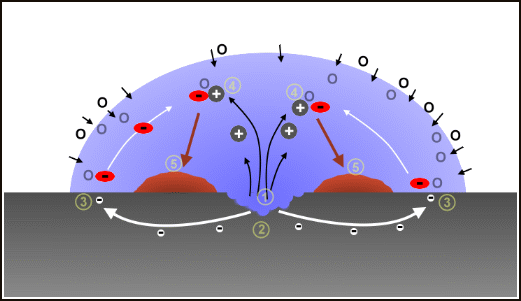
Putcorrosie
Putcorrosie (Engels: pitting) is een vorm van corrosie, waarbij zich putjes in het oppervlak vormen.
Putcorrosie treedt op bij metalen die zich tegen corrosie beschermen met een oxidelaag. Putcorrosie ontstaat voornamelijk op de plek waar de oxidelaag is beschadigd. Ongewenste metaaldeeltjes in het oppervlakte en penetratie van chloride-ionen door de beschermende laag kunnen ook putcorrosie veroorzaken. Het gevaar van putcorrosie is dat het metaal er uiterlijk ogenschijnlijk gaaf uitziet. Putcorrosie komt veelal naast een lasnaad voor.
Als roestvast staal waarvan de beschermende chroom(III)oxidelaag beschadigd is in contact komt met chloridehoudend water, bijvoorbeeld zeewater of zwembadwater, dan zullen de chloride-ionen voorkomen dat de beschermende laag zich herstelt. In het begin zal de beschadigde plek zowel voor anode als voor kathode fungeren:
Doordat het ijzer langzaam oplost, ontstaat er een putje, dat steeds dieper wordt. Op een gegeven moment treedt er in het putje zuurstoftekort op. Er ontstaat dan een galvanische cel tussen de oxidelaag (kathode) en het putje (anode). Het putje wordt steeds zuurder door ijzerhydrolyse en de corrosie versnelt:



